分析测试中心助力我校李明强团队开发抗蛋白吸附膜融合型脂质体实现体内高效胞内递送
膜融合是一种高效的细胞内递送策略,药物通过膜融合可以绕开经内涵体/溶酶体途径的胞吞途径,直接释放到细胞质中,避免降解风险。然而,膜融合载体在体内易吸附血清蛋白形成蛋白冠,会将其膜融合性能转化为溶酶体依赖性内吞作用,导致药物的胞内递送效率明显降低。
近日,中山大学李明强团队开发了一种抗蛋白吸附的膜融合型脂质体(antifouling membrane-fusogenic liposome,AFMFlip),以实现有效的细胞内递送。与传统膜融合脂质体MFlip-a和MFlip-b相比,AFMFlip由特定脂质组成,大量的两性离子磷酰胆碱基团能够抵抗蛋白质的吸附,使其在高丰度蛋白条件下依然具备高效的膜融合能力。
该工作利用分析测试中心透射电子显微分析技术(FEI Tecnai G2 F30, Tecnai G2 spirit 120 kV)辅助证明了AFMFlip脂质体材料的成功制备(图1左上)及CaCO3被AFMFlip脂质体成功包覆形成的核壳结构(图1左下),同时也对脂质体材料与蛋白质的相互作用进行了直接观测(图2)。结果表明,传统膜融合脂质体MFlip-a和MFlip-b在静脉注射之小鼠体内后,其表面会不可避免地吸附血清中的蛋白,形成蛋白冠(图2中和右);而团队开发的AFMFlip具有良好的抗蛋白吸附性能,仍能保持其原有结构(图2左)。
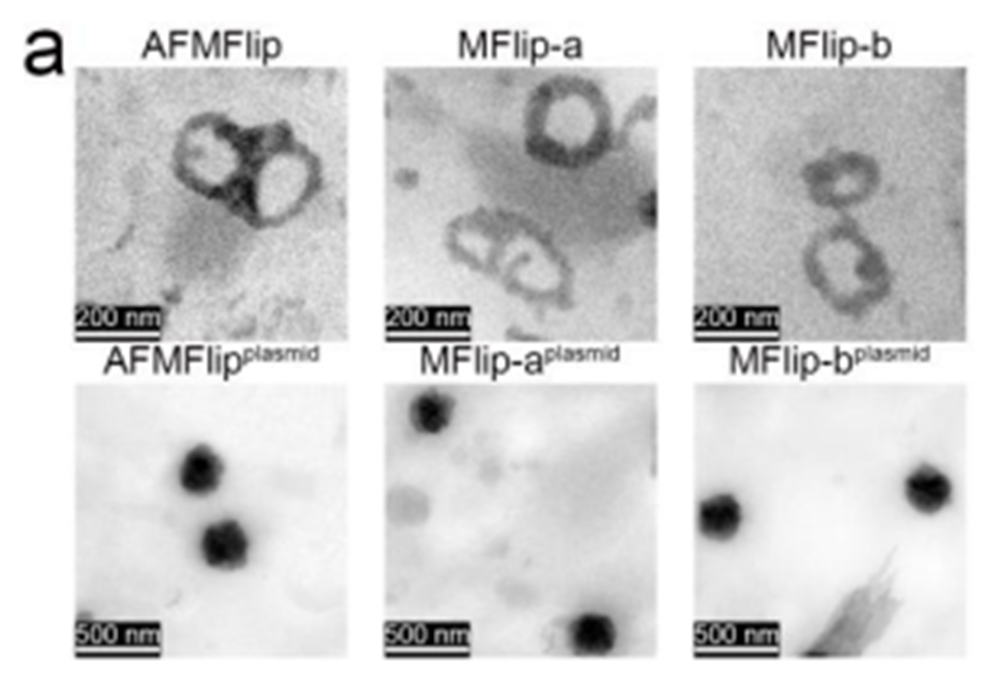
图1 AFMFlip、MFlip-a和MFlip-b 在有无包裹CaCO3/质粒纳米粒子下的TEM图像(详见原文Supplementary Figure 11.)
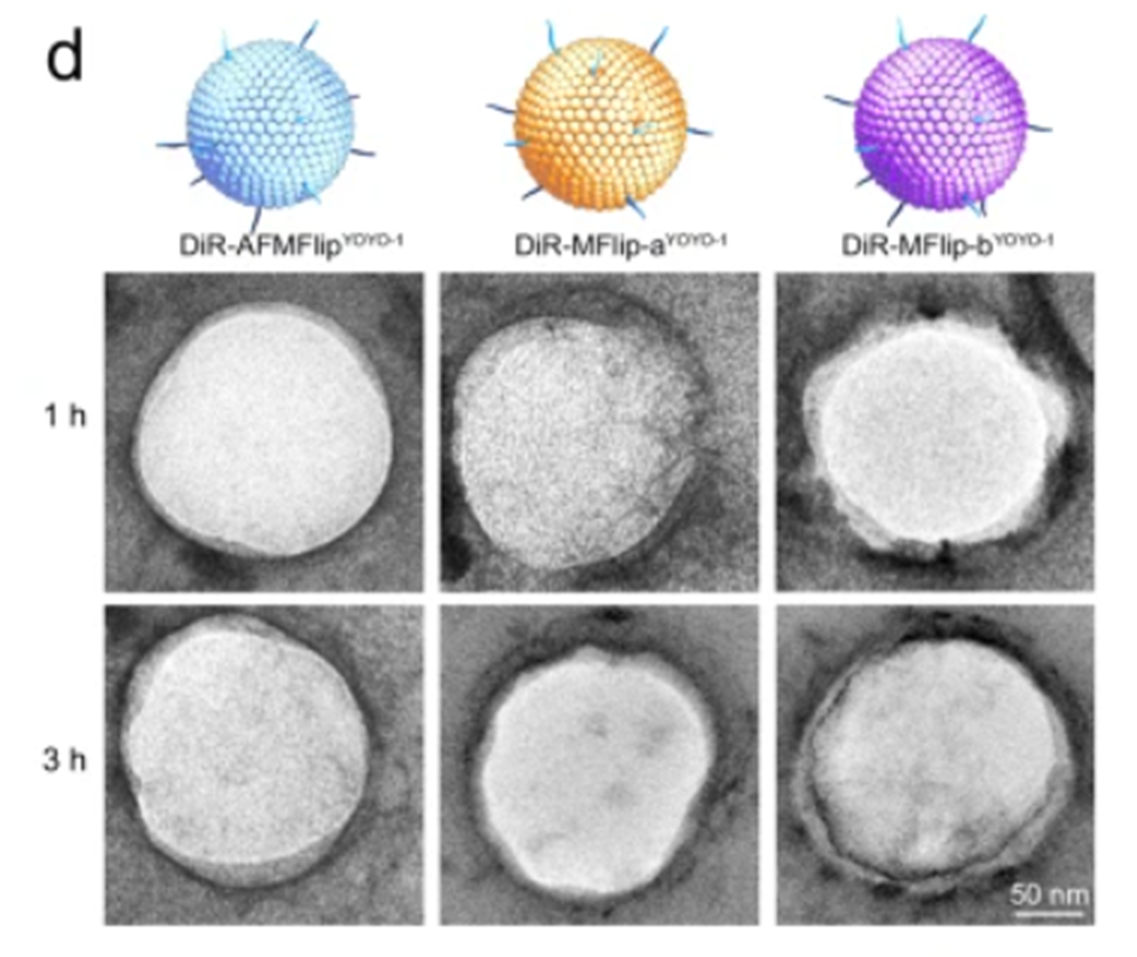
图2 DiR-AFMFlipYOYO-1、DiR-MFlip-aYOYO-1和DiR-MFlip-bYOYO-1在静脉注射1h和3h时回收后的TEM图像(详见原文Figure 5d.)
这项工作以“An antifouling membrane-fusogenic liposome for effective intracellular delivery in vivo”为题,发表在国际知名期刊《Nature Communications》上。文章的第一作者是中山大学附属第三医院生物材料与转化医学实验室博士孔慧敏和博士后郑春雄,我校李明强研究员为文章的通讯作者。
论文题目
An antifouling membrane-fusogenic liposome for effective intracellular delivery in vivo
发表期刊
《Nature Communications》
支撑设备
300 kV场发射透射电镜(FEI Tecnai G2 F30)

120kV透射电子显微镜(Tecnai G2 spirit 120 kV)

原文链接
https://doi.org/10.1038/s41467-024-46533-z
近年来,分析测试中心不断加强仪器功能拓展和技术方法创新,以高水平的分析测试服务扎实支撑学校学科建设与发展。更多仪器设备介绍,可点击本网站“仪器介绍”版块查看。


 分析测试服务指引
分析测试服务指引